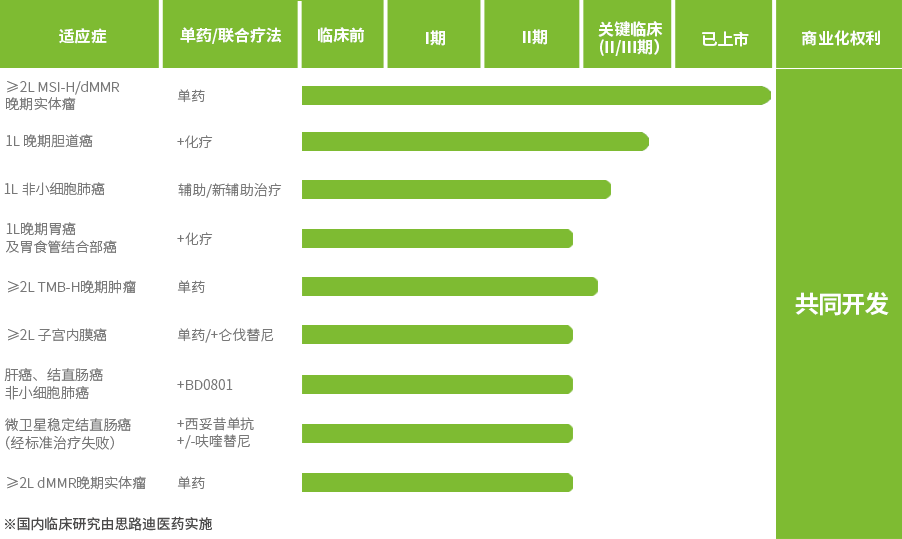
وپ©ç»´è¾¾®ï¼ˆوپ©و²ƒهˆ©هچ•وٹ—و³¨ه°„و¶²ï¼›ç ”هڈ‘ن»£هڈ·ï¼ڑKN035)* وک¯è‡ھن¸»ç ”هڈ‘çڑ„çڑ®ن¸‹و³¨ه°„PD-L1هچ•هںںوٹ—ن½“Fcèچهگˆè›‹ç™½م€‚2021ه¹´11وœˆهœ¨ن¸ه›½èژ·و‰¹ن¸ٹه¸‚,适用ن؛ژن¸چهڈ¯هˆ‡é™¤وˆ–转移و€§ه¾®هچ«وکںé«که؛¦ن¸چ稳ه®ڑ(MSI-H)وˆ–é”™é…چن؟®ه¤چهں؛ه› ç¼؛é™·ه‹ï¼ˆdMMR)ه®ن½“çک¤م€‚
وپ©ç»´è¾¾®é€ڑè؟‡é«کو•ˆéک»و–PD-1ه’ŒPD-L1çڑ„结هگˆï¼Œو؟€و´»é’ˆه¯¹è‚؟çک¤çڑ„ه…چç–«هڈچه؛”م€‚ه…¶هˆ†هگé‡ڈوک¯و™®é€ڑوٹ—ن½“çڑ„ن¸€هچٹ,ه…·وœ‰و›´ه¥½çڑ„组织ç©؟é€ڈو€§ï¼Œé€ڑè؟‡و·‹ه·´ه¾ھçژ¯ç³»ç»ںهˆ°è¾¾è‚؟çک¤ç»„织م€‚
KN035 : و™¶ن½“结و„
وپ©ç»´è¾¾®هœ¨ن¾؟هˆ©و€§ه’Œن¾ن»ژو€§و–¹é¢ه…·وœ‰وک¾è‘—ن¼کهٹ؟,و‚£è€…و— 需è؟›è،Œé™è„‰و»´و³¨ï¼Œهڈ¯ن»¥هœ¨30秒ه†…ه®Œوˆگç»™èچ¯ï¼Œه°¤ه…¶é€‚用ن؛ژن½“ه¼±م€پé«ک龄هڈٹوœ‰é™è„‰è¾“و³¨هڈچه؛”çڑ„و‚£è€…م€‚
ç›®ه‰چوپ©ç»´è¾¾®è؟کوœ‰ه¤ڑن¸ھن¸´ه؛ٹç ”ç©¶هœ¨è؟›è،Œن¸ï¼Œè؟›ن¸€و¥و‹“ه±•é€‚ه؛”ç—‡م€‚èپ”هگˆهگ‰è¥؟ن»–و»¨ه’Œه¥¥و²™هˆ©é“‚(GEMOX)و–¹و،ˆç”¨ن؛ژن¸€ç؛؟و²»ç–—ن¸چهڈ¯هˆ‡é™¤وˆ–转移و€§èƒ†éپ“癌适ه؛”ç—‡çڑ„و–°èچ¯ن¸ٹه¸‚申请ه·²èژ·ه›½ه®¶èچ¯ه“پ监ç£ç®،çگ†ه±€ï¼ˆNMPA)هڈ—çگ†م€‚
وپ©ç»´è¾¾®ه·²èژ·ç¾ژه›½é£ںه“پèچ¯ه“پ监ç£ç®،çگ†ه±€ï¼ˆFDA)وژˆن؛ˆن¸‰é،¹ه¤ه„؟èچ¯èµ„و ¼ï¼Œç”¨ن؛ژو²»ç–—و™ڑوœں胆éپ“癌م€پ软组织肉çک¤هڈٹ胃癌ه’Œèƒƒé£ںç®،结هگˆéƒ¨ç™Œï¼›èژ·NMPAوژˆن؛ˆçھپç ´و€§ç–—و³•è®¤ه®ڑ,用ن؛ژو²»ç–—é«کè‚؟çک¤çھپهڈکè½½èچ·ï¼ˆTMB-H)ن¸چهڈ¯هˆ‡é™¤وˆ–转移و€§ه®ن½“çک¤م€‚
ASCO 2020 posterï¼ڑوپ©و²ƒهˆ©هچ•وٹ—(KN035)用ن؛ژé”™é…چن؟®ه¤چç¼؛é™·çڑ„و™ڑوœںè‚؟çک¤çڑ„ن¸´ه؛ٹو•°وچ®
ASCO 2019 posterï¼ڑKN035هœ¨و—¥وœ¬و™ڑوœںه®ن½“çک¤و‚£è€…ن¸çڑ„ه®‰ه…¨و€§ه’Œèچ¯ن»£هٹ¨هٹ›ه¦ç ”究
ASCO 2019 posterï¼ڑKN035هœ¨ن¸ه›½و™ڑوœںه®ن½“çک¤و‚£è€…ن¸çڑ„â… وœںن¸´ه؛ٹç ”ç©¶
ESMO 2018 posterï¼ڑKN035(ن¸€ç§چو–°ه‹وٹ—PD-L1èچهگˆوٹ—ن½“)هœ¨ç¾ژه›½و™ڑوœںه®ن½“çک¤و‚£è€…ن¸çڑ„â… وœںن¸´ه؛ٹç ”ç©¶
ه®‰ه°¼ه¦¥هچ•وٹ—و³¨ه°„و¶²ï¼ˆç ”هڈ‘ن»£هڈ·ï¼ڑKN026)* وک¯é‡‡ç”¨ه…·وœ‰è‡ھن¸»çں¥è¯†ن؛§وƒFcه¼‚ن؛Œèپڑن½“ه¹³هڈ°وٹ€وœ¯(CRIB)ه¼€هڈ‘çڑ„HER2هڈŒç‰¹ه¼‚و€§وٹ—ن½“,هڈ¯هگŒو—¶ç»“هگˆHER2çڑ„ن¸¤ن¸ھéé‡چهڈ è،¨ن½چ,éک»و–HER2ن؟،هڈ·م€‚é€ڑè؟‡وٹ—ن½“诱ه¯¼çڑ„هڈ—ن½“èپڑ集,ه¢ه¼؛ADCCه’ŒCDCو•ˆه؛”,هگŒو—¶ن¸‹è°ƒç»†èƒè،¨é¢HER2هڈ—ن½“م€‚
KN026 : و™¶ن½“结و„
2025ه¹´9وœˆï¼Œه®‰ه°¼ه¦¥هچ•وٹ—هœ¨HER2éک³و€§èƒƒç™Œé€‚ه؛”ç—‡çڑ„首ن¸ھو–°èچ¯ن¸ٹه¸‚申请èژ·ه›½ه®¶èچ¯ه“پ监ç£ç®،çگ†ه±€ï¼ˆNMPA)هڈ—çگ†م€‚ç›®ه‰چé’ˆه¯¹ن؛Œç؛؟هڈٹن»¥ن¸ٹHER2éک³و€§èƒƒç™Œ/胃é£ںç®،结هگˆéƒ¨ç™Œم€پن¸€ç؛؟HER2éک³و€§ن¹³è…؛癌م€پHER2éک³و€§ن¹³è…؛癌و–°è¾…هٹ©ç‰é€‚ه؛”ç—‡çڑ„ه¤ڑé،¹و³¨ه†Œن¸´ه؛ٹç ”ç©¶و£هœ¨è؟›è،Œن¸م€‚
ه®‰ه°¼ه¦¥هچ•وٹ—ه·²èژ·ç¾ژه›½é£ںه“پèچ¯ه“پ监ç£ç®،çگ†ه±€ï¼ˆFDA)وژˆن؛ˆه¤ه„؟èچ¯èµ„و ¼ï¼Œç”¨ن؛ژو²»ç–—HER2éک³و€§وˆ–HER2ن½ژè،¨è¾¾èƒƒç™Œï¼›èژ·ه›½ه®¶èچ¯ه“پ监ç£ç®،çگ†ه±€ï¼ˆNMPA)وژˆن؛ˆçھپç ´و€§ç–—و³•è®¤ه®ڑ,用ن؛ژن¸€ç؛؟و ‡ه‡†و²»ç–—ه¤±è´¥çڑ„HER2éک³و€§èƒƒç™Œï¼ˆهŒ…و‹¬èƒƒ-é£ںç®،结هگˆéƒ¨è…؛癌)م€‚

SABCS 2023 posterï¼ڑHER2هڈŒç‰¹ه¼‚و€§وٹ—ن½“KN026èپ”هگˆه¤ڑè¥؟ن»–èµ›ن¸€ç؛؟و²»ç–—HER2éک³و€§ه¤چهڈ‘وˆ–转移ن¹³è…؛癌çڑ„ن¸¤ه¹´هچٹéڑڈè®؟و•°وچ®
ESMO 2023 posterï¼ڑKN026èپ”هگˆه¤ڑè¥؟ن»–赛用ن؛ژHER2éک³و€§و—©وœںوˆ–ه±€éƒ¨و™ڑوœںن¹³è…؛癌çڑ„و–°è¾…هٹ©و²»ç–—ï¼ڑن¸€é،¹هچ•è‡‚م€په¤ڑن¸ه؟ƒم€پâ…،وœںç ”ç©¶
ESMO 2023 posterï¼ڑKN026èپ”هگˆه¤ڑè¥؟ن»–èµ›ن¸€ç؛؟و²»ç–—HER2éک³و€§ه¤چهڈ‘وˆ–转移و€§ن¹³è…؛癌çڑ„ç–—و•ˆه’Œه®‰ه…¨و€§ن¸¤ه¹´éڑڈè®؟
SABCS 2022 posterï¼ڑHER2هڈŒç‰¹ه¼‚و€§وٹ—ن½“KN026èپ”هگˆه¤ڑè¥؟ن»–èµ›ن¸€ç؛؟و²»ç–—HER2éک³و€§ه¤چهڈ‘/转移و€§ن¹³è…؛癌çڑ„ç–—و•ˆه’Œه®‰ه…¨و€§ç»“وœ
SABCS 2022 posterï¼ڑKN026èپ”هگˆه¤ڑè¥؟ن»–赛用ن؛ژHER2éک³و€§و—©وœںوˆ–ه±€éƒ¨و™ڑوœںن¹³è…؛癌çڑ„و–°è¾…هٹ©و²»ç–—ï¼ڑن¸€é،¹هچ•è‡‚م€په¤ڑن¸ه؟ƒم€پâ…،وœںç ”ç©¶
ASCO 2022 posterï¼ڑKN026هگژç؛؟و²»ç–—و™ڑوœںHER2è،¨è¾¾çڑ„胃癌وˆ–胃é£ںç®،结هگˆéƒ¨ç™Œçڑ„â…،وœںن¸´ه؛ٹç ”ç©¶
ASCO 2021 Abstractï¼ڑHER2هڈŒç‰¹ه¼‚و€§وٹ—ن½“KN026هœ¨و™ڑوœںHER2éک³و€§èƒƒه’Œèƒƒé£ںç®،结هگˆéƒ¨ç™Œو‚£è€…ن¸çڑ„هˆو¥ç–—و•ˆ
AACR 2020 posterï¼ڑن½؟用转译è‚؟çک¤ç”ںé•؟وٹ‘هˆ¶و¨،ه‹هڈٹ群ن½“èچ¯ن»£هٹ¨هٹ›ه¦هˆ†وگو–¹و³•é¢„وµ‹HER2هڈŒç‰¹ه¼‚و€§وٹ—ن½“KN026çڑ„وœ‰و•ˆه‰‚é‡ڈ
ASCO 2020 posterï¼ڑHER2هڈŒç‰¹ه¼‚و€§وٹ—ن½“KN026هœ¨HER2éک³و€§è½¬ç§»و€§ن¹³è…؛癌و‚£è€…ن¸çڑ„هˆو¥ه®‰ه…¨و€§م€پوœ‰و•ˆو€§ه’Œèچ¯ن»£هٹ¨هٹ›ه¦(PK)结وœ
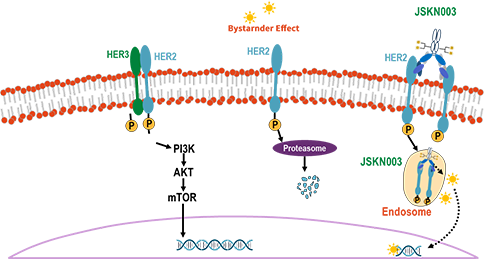
و™®ه؛·ه®‰ه°¼ه¦¥هچ•وٹ—و³¨ه°„و¶²ï¼ˆç ”هڈ‘ن»£هڈ·ï¼ڑJSKN003)é€ڑè؟‡ه°†ه®‰ه°¼ه¦¥هچ•وٹ—(KN026)Fcن¸ٹç³–هں؛ه®ڑ点هپ¶èپ”èژ·ه¾—DAR4çڑ„ه‡ن¸€ç¨³ه®ڑçڑ„ADCم€‚JSKN003能ه¤ں结هگˆè‚؟çک¤ç»†èƒHER2çڑ„ن¸¤ن¸ھè،¨ن½چ,é€ڑè؟‡ه¢ه¼؛细èƒه†…هگé‡ٹو”¾و‹“و‰‘ه¼‚و„é…¶â… وٹ‘هˆ¶ه‰‚,هڈ‘وŒ¥è‚؟çک¤و€ن¼¤ن½œç”¨م€‚
JSKN003较هگŒç±»ADCèچ¯ç‰©ه…·وœ‰و›´ه¥½çڑ„è،€و¸…稳ه®ڑو€§م€پو›´ن½ژçڑ„è،€و¶²ه¦و¯’و€§م€پو›´ه¼؛çڑ„è‚؟çک¤وٹ‘هˆ¶ه’Œو—پ观者و€ن¼¤و•ˆه؛”,وک¾è‘—و‰©ه¤§ن؛†و²»ç–—çھ—م€‚
JSKN003هœ¨ن؛Œç؛؟HER2éک³و€§ن¹³è…؛癌çڑ„â…¢وœںن¸´ه؛ٹç ”ç©¶ه·²ه®Œوˆگه…¥ç»„,预è®،2026ه¹´é€’ن؛¤ن¸ٹه¸‚申请م€‚و¤ه¤–وœ‰ه¤ڑé،¹و³¨ه†Œن¸´ه؛ٹç ”ç©¶و£هœ¨è؟›è،Œن¸ï¼ŒهŒ…و‹¬ه…¨ن؛؛群铂è€گèچ¯هچµه·¢ç™Œم€پHER2ن½ژè،¨è¾¾ن¹³è…؛癌م€پHER2éک³و€§ç»“ç›´è‚ ç™Œç‰م€‚
JSKN003ه·²èژ·ç¾ژه›½é£ںه“پèچ¯ه“پ监ç£ç®،çگ†ه±€ï¼ˆFDA)وژˆن؛ˆه¤ه„؟èچ¯èµ„و ¼ï¼Œç”¨ن؛ژو²»ç–—胃癌هڈٹ胃é£ںç®،结هگˆéƒ¨ç™Œï¼ˆGC/GEJ);ه·²èژ·FDAوژˆن؛ˆه؟«é€ںé€ڑéپ“资و ¼è®¤ه®ڑ,用ن؛ژو²»ç–—ن¸چé™گHER2è،¨è¾¾و°´ه¹³çڑ„و™ڑوœںوˆ–转移و€§é“‚è€گèچ¯ه¤چهڈ‘و€§ن¸ٹçڑ®و€§هچµه·¢ç™Œم€پهژںهڈ‘و€§è…¹è†œç™Œوˆ–输هچµç®،癌(PROC);ه·²èژ·FDAوژˆن؛ˆçھپç ´و€§ç–—و³•è®¤ه®ڑ,用ن؛ژو²»ç–—è´ن¼گçڈ هچ•وٹ—ç»ڈو²»çڑ„HER2وœ‰è،¨è¾¾PROCï¼› ه·²èژ·ه›½ه®¶èچ¯ه“پ监ç£ç®،çگ†ه±€ï¼ˆNMPA)وژˆن؛ˆن¸¤é،¹çھپç ´و€§ç–—و³•è®¤ه®ڑ,用ن؛ژو²»ç–—PROC,هڈٹه¥¥و²™هˆ©é“‚م€پو°ںه°؟هک§ه•¶ه’Œن¼ٹç«‹و›؟ه؛·و²»ç–—ه¤±è´¥çڑ„HER2éک³و€§و™ڑوœںç»“ç›´è‚ ç™Œم€‚
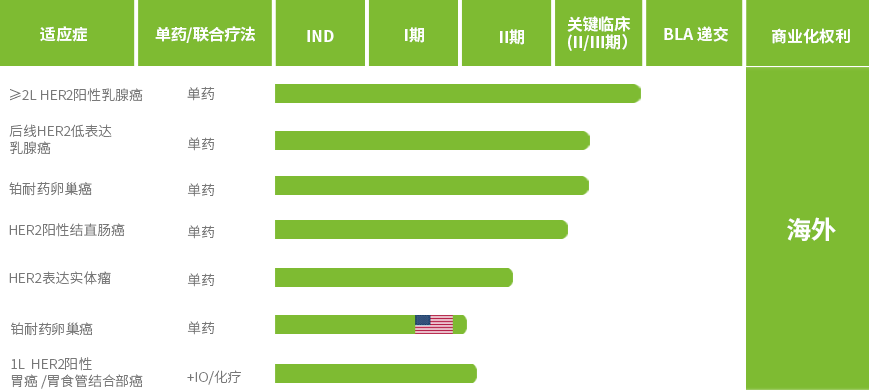
ESMO 2025 posterï¼ڑHER2هڈŒوٹ—هپ¶èپ”èچ¯ç‰©ï¼ˆADC)JSKN003و²»ç–—هژںهڈ‘و€§é“‚éڑ¾و²»هچµه·¢ç™Œ
ESMO 2025 posterï¼ڑHER2هڈŒوٹ—هپ¶èپ”èچ¯ç‰©ï¼ˆADC)JSKN003هœ¨HER2éک³و€§è½¬ç§»و€§ç»“ç›´è‚ ç™Œï¼ˆmCRC)و‚£è€…ن¸çڑ„ç–—و•ˆن¸ژه®‰ه…¨و€§
ESMO 2025 posterï¼ڑJSKN003-306ï¼ڑHER2هڈŒوٹ—هپ¶èپ”èچ¯ç‰©ï¼ˆADC)JSKN003ه¯¹و¯”ç ”ç©¶è€…é€‰و‹©هŒ–ç–—و²»ç–—é“‚è€گèچ¯هچµه·¢ç™Œï¼ˆPROC)çڑ„â…¢وœںن¸´ه؛ٹç ”ç©¶
ASCO 2025 posterï¼ڑHER2هڈŒوٹ—ADC JSKN003و²»ç–—é“‚è€گèچ¯هچµه·¢ç™Œï¼ˆPROC)çڑ„ن¸´ه؛ٹç ”ç©¶ç»“وœو›´و–°ï¼ڑن¸¤é،¹ن¸´ه؛ٹç ”ç©¶و•°وچ®و±‡و€»
ASCO 2025 posterï¼ڑHER2هڈŒوٹ—ADC JSKN003用ن؛ژه¤ڑç؛؟و²»ç–—هگژè؟›ه±•çڑ„HER2éک³و€§ن¹³è…؛癌ï¼ڑن¸€é،¹و—©وœںéک¶و®µç ”究çڑ„و±‡و€»هˆ†وگ
ASCO 2025 posterï¼ڑHER2هڈŒوٹ—ADC JSKN003و²»ç–—و™ڑوœںHER2é«کè،¨è¾¾ï¼ˆIHC 3+ï¼‰èƒƒè‚ éپ“è‚؟çک¤و‚£è€…çڑ„و±‡و€»هˆ†وگ
ESMO 2024 posterï¼ڑJSKN003(ن¸€ç§چHER2é¶هگ‘وٹ—ن½“هپ¶èپ”èچ¯ç‰©ï¼‰و²»ç–—é“‚è€گèچ¯هچµه·¢ç™Œو‚£è€…ï¼ڑن¸¤é،¹ç ”究çڑ„و±‡و€»هˆ†وگ
ESMO 2024 posterï¼ڑJSKN003و²»ç–—و™ڑوœںHER2éک³و€§ï¼ˆIHC 3+)ه®ن½“çک¤ï¼ˆن¹³è…؛癌除ه¤–)و‚£è€…çڑ„ه®‰ه…¨و€§ه’Œوœ‰و•ˆو€§
ASCO 2024 posterï¼ڑJSKN003هœ¨و™ڑوœںه®ن½“çک¤و‚£è€…ن¸çڑ„ه®‰ه…¨و€§م€پèچ¯ن»£هٹ¨هٹ›ه¦ه’Œç–—و•ˆè¯„ن¼°ï¼ڑâ… /â…،وœںن¸´ه؛ٹç ”ç©¶
AACR 2024 posterï¼ڑJSKN003用ن؛ژو²»ç–—و™ڑوœں/转移و€§ه®ن½“çک¤çڑ„ه®‰ه…¨و€§ه’Œç–—و•ˆï¼ڑن¸€é،¹é¦–و¬،هœ¨ن؛؛ن½“ن¸è؟›è،Œçڑ„م€په‰‚é‡ڈ递ه¢ه’Œه‰‚é‡ڈو‰©ه±•م€په¤ڑن¸ه؟ƒم€په¼€و”¾çڑ„Iوœںç ”ç©¶
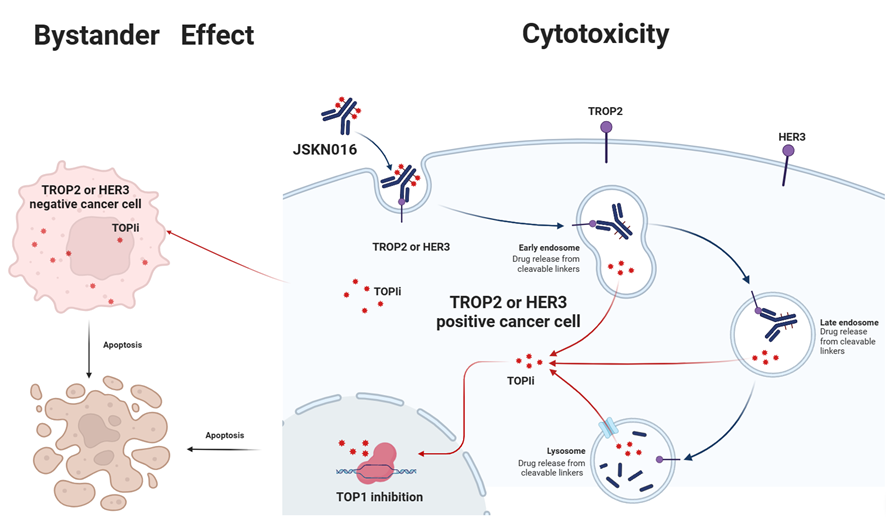
JSKN016وک¯هˆ©ç”¨هچ•هںںوٹ—ن½“ه’ŒهڈŒوٹ—ه¹³هڈ°ه¼€هڈ‘çڑ„é¶هگ‘TROP2ه’ŒHER3هڈŒوٹ—,é€ڑè؟‡ç³–هں؛ه®ڑ点هپ¶èپ”èژ·ه¾—DAR4çڑ„ه‡ن¸€ç¨³ه®ڑçڑ„ADCم€‚
JSKN016ن¸ژè‚؟çک¤ç»†èƒè،¨é¢çڑ„هڈ—ن½“结هگˆهگژ,éک»و–相ه؛”ن؟،هڈ·é€ڑ路,é€ڑè؟‡ه¢ه¼؛细èƒه†…هگé‡ٹو”¾و‹“و‰‘ه¼‚و„é…¶â… وٹ‘هˆ¶ه‰‚,هڈ‘وŒ¥è‚؟çک¤و€ن¼¤ن½œç”¨م€‚
JSKN016هœ¨ه¤ڑç§چه®ن½“çک¤ن¸وک¾ç¤؛ه‡؛良ه¥½çڑ„وٹ—è‚؟çک¤و´»و€§ه’Œه®‰ه…¨و€§م€‚ç›®ه‰چه·²ç»ڈه®Œوˆگه‰‚é‡ڈن¼کهŒ–ه’Œç،®è®¤ï¼Œهچ³ه°†è؟›ه…¥â…¢وœںن¸´ه؛ٹç ”ç©¶م€‚
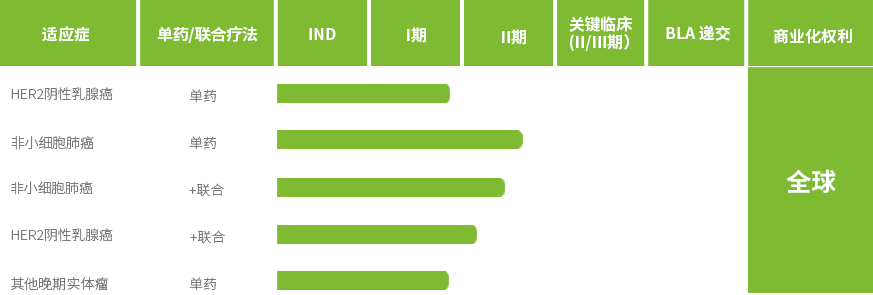
JSKN033وک¯è‡ھن¸»ç ”هڈ‘çڑ„ADC(JSKN003)* ه’ŒPD-L1(وپ©و²ƒهˆ©هچ•وٹ—)* 组وˆگçڑ„é«کوµ“ه؛¦çڑ®ن¸‹و³¨ه°„ه¤چو–¹هˆ¶ه‰‚م€‚
JSKN033结هگˆه…چç–«و²»ç–—ه’ŒADCçڑ„ن¼کهٹ؟,ه¹¶é€ڑè؟‡çڑ®ن¸‹ç»™èچ¯è؟›ن¸€و¥وڈگهچ‡ه®‰ه…¨و€§ه’Œهڈ¯هڈٹو€§م€‚
ç›®ه‰چJSKN033و£هœ¨ن¸ه›½ه’Œو¾³ه¤§هˆ©ن؛ڑه¼€ه±•ç”¨ن؛ژو²»ç–—ه®ن½“çک¤çڑ„â… /â…،وœںن¸´ه؛ٹç ”ç©¶ï¼Œو²»ç–—HER2çھپهڈک/وœ‰è،¨è¾¾éه°ڈ细èƒè‚؛癌çڑ„â…،وœںç ”ç©¶ن¹ںهœ¨è؟›è،Œن¸م€‚èپ”هگˆهŒ–ç–—ن¸€ç؛؟و²»ç–—و™ڑوœںه®«é¢ˆç™Œçڑ„â…،وœںن¸´ه؛ٹ试éھŒç”³è¯·ه·²èژ·CDEهڈ—çگ†م€‚

SITC 2024 posterï¼ڑHER2هڈŒç‰¹ه¼‚و€§وٹ—ن½“هپ¶èپ”èچ¯ç‰©ن¸ژPD-L1وٹ‘هˆ¶ه‰‚çڑ„هˆ›و–°ه‹çڑ®ن¸‹و³¨ه°„é«کوµ“ه؛¦ه¤چو–¹هˆ¶ه‰‚JSKN033ï¼ڑ用ن؛ژو²»ç–—و™ڑوœںه®ن½“çک¤
JSKN022وک¯هˆ©ç”¨وٹ—ن½“ه®ڑهگ‘è؟›هŒ–,èژ·ه¾—é’ˆه¯¹PD-L1ه’Œو•´هگˆç´ αvβ6çڑ„هڈŒهٹں能هچ•هںںوٹ—ن½“,é€ڑè؟‡ç³–هں؛ه®ڑ点هپ¶èپ”èژ·ه¾—DAR4çڑ„ه‡ن¸€ç¨³ه®ڑçڑ„ADCم€‚

ن¸ژè‚؟çک¤ç»†èƒè،¨é¢çڑ„PD-L1ه’Œ/وˆ–و•´هگˆç´ αvβ6结هگˆهگژ,é€ڑè؟‡ه†…هگ,é‡ٹو”¾و‹“و‰‘ه¼‚و„é…¶Iوٹ‘هˆ¶ه‰‚,و€ن¼¤è‚؟çک¤ç»†èƒم€‚JSKN022éک»و–PD-L1ه’ŒPD-1,و؟€و´»è‚؟çک¤ه…چç–«هڈچه؛”م€‚هگŒو—¶éک»و–αvβ6و•´هگˆç´ ,وٹ‘هˆ¶TGFB1/3çڑ„ç”ںوˆگ,و”¹هڈکè‚؟çک¤ه…چç–«ه¾®çژ¯ه¢ƒم€‚
ç›®ه‰چJSKN022و£هœ¨ن¸ه›½ه¼€ه±•â… وœںن¸´ه؛ٹç ”ç©¶م€‚

JSKN027وک¯ن¸€ç§چه…¨çگƒé¦–هˆ›çڑ„هڈ¯هگŒو—¶é¶هگ‘PD-L1ه’ŒVEGFR2çڑ„هڈŒç‰¹ه¼‚و€§وٹ—ن½“هپ¶èپ”èچ¯ç‰©ï¼ˆADC)م€‚é€ڑè؟‡ç³–هں؛ه®ڑ点هپ¶èپ”وٹ€وœ¯ه°†هڈ¯è£‚解è؟وژ¥هگهڈٹو‹“و‰‘ه¼‚و„é…¶Iوٹ‘هˆ¶ه‰‚è½½èچ·ç²¾ه‡†هپ¶èپ”至وٹ—ن½“çڑ„FcهŒ؛هںں,هœ¨ن؟وŒپ良ه¥½ه®‰ه…¨و€§çڑ„هگŒو—¶ه®çژ°وœ‰و•ˆçڑ„وٹ—è‚؟çک¤و´»و€§م€‚
JSKN027çڑ„وٹ—è‚؟çک¤ن½œç”¨هں؛ن؛ژه…¶ç‹¬ç‰¹çڑ„ن¸‰é‡چهچڈهگŒوœ؛هˆ¶ï¼ڑ除ه…·ه¤‡ADCه…¸ه‹çڑ„é¶هگ‘و€ن¼¤هڈٹو—پ观者و•ˆه؛”ه¤–,è؟کهڈ¯ن»¥é€ڑè؟‡éک»و–VEGF/VEGFR2ن؟،هڈ·é€ڑè·¯وٹ‘هˆ¶è‚؟çک¤è،€ç®،ç”ںوˆگ,ه¹¶é€ڑè؟‡éک»و–PD-1/PD-L1ه…چç–«و£€وں¥ç‚¹ن؟،هڈ·é€ڑ路解除ه…چç–«وٹ‘هˆ¶م€‚ن»¥ن¸ٹ综هگˆوœ؛هˆ¶وœ‰هٹ©ن؛ژه¢ه¼؛وٹ—è‚؟çک¤و²»ç–—çڑ„و•´ن½“ç–—و•ˆï¼Œه¹¶ه…‹وœچه‰چç؛؟و²»ç–—è€گèچ¯م€‚JSKN027وœ‰وœ›ن¸؛ه¤ڑç§چه®ن½“çک¤و‚£è€…وڈگن¾›و–°çڑ„و²»ç–—选و‹©م€‚
JSKN027用ن؛ژو™ڑوœںوپ¶و€§ه®ن½“çک¤çڑ„â… وœںن¸´ه؛ٹ试éھŒç”³è¯·ه·²èژ·CDEهڈ—çگ†م€‚

KN019وک¯è´و‹‰è¥؟و™®ï¼ˆBelatacept,英و–‡ه•†ه“پهگچï¼ڑNulojix®ï¼‰çڑ„ç”ں物类ن¼¼èچ¯م€‚
KN019ه·²ه®Œوˆگâ…،وœںن¸´ه؛ٹç ”ç©¶ه¹¶هڈ–ه¾—éک³و€§ç»“وœم€‚2023ه¹´11وœˆï¼ŒKN019èژ·ه¾—ه›½ه®¶èچ¯ه“پ监ç£ç®،çگ†ه±€é¢پهڈ‘çڑ„çڑ®ن¸‹هˆ¶ه‰‚ن¸´ه؛ٹو‰¹ن»¶م€‚

KN046وک¯è‡ھن¸»ç ”هڈ‘çڑ„PD-L1/CTLA-4هڈŒç‰¹ه¼‚و€§وٹ—ن½“,هڈ¯é¶هگ‘ه¯Œé›†ن؛ژPD-L1é«کè،¨è¾¾çڑ„è‚؟çک¤ه¾®çژ¯ه¢ƒهڈٹو¸…除وٹ‘هˆ¶è‚؟çک¤ه…چç–«çڑ„Treg细èƒم€‚
KN046هœ¨ن¸ه›½م€پç¾ژه›½هڈٹو¾³ه¤§هˆ©ن؛ڑçڑ„ه¤ڑé،¹ن¸´ه؛ٹç ”ç©¶هœ¨è؟›è،Œن¸م€‚
KN046ه·²èژ·ç¾ژه›½é£ںه“پèچ¯ه“پ监ç£ç®،çگ†ه±€ï¼ˆFDA)وژˆن؛ˆه¤ه„؟èچ¯èµ„و ¼ï¼Œç”¨ن؛ژو²»ç–—胸è…؛ن¸ٹçڑ®è‚؟çک¤م€‚

KN046 : و™¶ن½“结و„
ESMO 2023 posterï¼ڑKN046ه¯¹و—¢ه¾€ن¸€ç؛؟و²»ç–—ه¤±è´¥çڑ„ه¤چهڈ‘/转移و€§èƒ¸è…؛癌و‚£è€…çڑ„ه¤ڑن¸ه؟ƒم€پهچ•è‡‚â…،وœںن¸´ه؛ٹç ”ç©¶
ESMO 2023 posterï¼ڑKN046èپ”هگˆéک؟وک”و›؟ه°¼ن¸€ç؛؟و²»ç–—و™ڑوœںéه°ڈ细èƒè‚؛癌çڑ„هچ•è‡‚م€په¼€و”¾و ‡ç¾م€په¤ڑن¸ه؟ƒâ…،وœںç ”ç©¶هˆو¥و•°وچ®
ESMO 2023 posterï¼ڑKN046用ن؛ژو—¢ه¾€وژ¥هڈ—è؟‡ه…چç–«و£€وں¥ç‚¹وٹ‘هˆ¶ه‰‚çڑ„转移و€§éه°ڈ细èƒè‚؛癌و‚£è€…çڑ„ç–—و•ˆه’Œه®‰ه…¨و€§ç»“وœ
ESMO 2023 posterï¼ڑKN046用ن؛ژو—¢ه¾€EGFR-TKI(s)و²»ç–—ه¤±è´¥çڑ„转移و€§éه°ڈ细èƒè‚؛癌و‚£è€…çڑ„ç–—و•ˆه’Œه®‰ه…¨و€§çڑ„وœ€و–°ç»“وœ
SABCS 2022 posterï¼ڑPD-L1/CTLA-4 هڈŒç‰¹ه¼‚و€§وٹ—ن½“KN046èپ”هگˆç™½è›‹ç™½ç´«و‰é†‡و²»ç–—转移و€§ن¸‰éک´ن¹³è…؛癌çڑ„ç–—و•ˆم€په®‰ه…¨و€§ه’Œè€گهڈ—و€§ï¼ڑâ…،وœںç ”ç©¶çڑ„وœ€ç»ˆç»“وœ
ESMO 2022 posterï¼ڑKN046(PD-L1/CTLA-4هڈŒç‰¹ه¼‚و€§وٹ—ن½“)用ن؛ژو—¢ه¾€EGFR-TKIsو²»ç–—ه¤±è´¥çڑ„转移و€§éه°ڈ细èƒè‚؛癌(NSCLC)و‚£è€…çڑ„â…،وœںç ”ç©¶
ESMO 2022 posterï¼ڑKN046(PD-L1/CTLA-4هڈŒç‰¹ه¼‚و€§وٹ—ن½“)用ن؛ژن¸€ç؛؟هŒ–ç–—و²»ç–—ه¤±è´¥çڑ„转移و€§éه°ڈ细èƒè‚؛癌(NSCLC)و‚£è€…çڑ„â…،وœںç ”ç©¶
ESMO 2022 posterï¼ڑKN046èپ”هگˆهگ«é“‚هڈŒèچ¯هŒ–ç–—ن¸€ç؛؟و²»ç–—éه°ڈ细èƒè‚؛癌(NSCLC)çڑ„ن¸¤ه¹´éڑڈè®؟ï¼ڑن¸€é،¹ه¼€و”¾و ‡ç¾م€په¤ڑن¸ه؟ƒçڑ„IIوœںç ”ç©¶
CSCO 2021 posterï¼ڑKN046èپ”هگˆç™½è›‹ç™½ç´«و‰é†‡/هگ‰è¥؟ن»–و»¨ن¸€ç؛؟و²»ç–—ن¸چهڈ¯هˆ‡é™¤ه±€éƒ¨و™ڑوœںوˆ–转移و€§èƒ°è…؛ه¯¼ç®،è…؛癌(PDAC)çڑ„وœ‰و•ˆو€§ه’Œه®‰ه…¨و€§
ESMO 2021 posterï¼ڑKN046èپ”هگˆن»‘ن¼گو›؟ه°¼ç”¨ن؛ژو²»ç–—و™ڑوœںن¸چهڈ¯هˆ‡é™¤وˆ–转移و€§è‚细èƒç™Œçڑ„ه‰چç»و€§â…،وœںن¸´ه؛ٹ试éھŒçڑ„هˆو¥ç–—و•ˆهڈٹه®‰ه…¨و€§ç»“وœ
ESMO 2021 posterï¼ڑKN046èپ”هگˆهگ«é“‚هڈŒèچ¯هŒ–ç–—ن½œن¸؛و²»ç–—ن¼´وœ‰è€گèچ¯و€§è‡´ç™Œé©±هٹ¨هں؛ه› çھپهڈکçڑ„و™ڑوœںéه°ڈ细èƒè‚؛癌و‚£è€…çڑ„ن¸€ç؛؟ç–—و³•
ASCO 2021 posterï¼ڑKN046èپ”هگˆé“‚ç±»هŒ–ç–—و²»ç–—و™ڑوœںéه°ڈ细èƒè‚؛癌و‚£è€…çڑ„ç–—و•ˆم€په®‰ه…¨و€§ه’Œè€گهڈ—و€§çڑ„â…،وœںم€په¼€و”¾م€په¤ڑن¸ه؟ƒç ”究
ASCO 2021 posterï¼ڑKN046èپ”هگˆç´«و‰é†‡/é،؛é“‚ن¸€ç؛؟و²»ç–—ن¸چهڈ¯هˆ‡é™¤ه±€éƒ¨و™ڑوœںم€په¤چهڈ‘وˆ–转移و€§é£ںç®،é³ç™Œ(ESCC)çڑ„ç–—و•ˆه’Œه®‰ه…¨و€§
ASCO 2021 posterï¼ڑKN046èپ”هگˆç™½è›‹ç™½ç´«و‰é†‡/هگ‰è¥؟ن»–و»¨ن½œن¸؛ن¸چهڈ¯هˆ‡é™¤çڑ„ه±€éƒ¨و™ڑوœںوˆ–转移و€§èƒ°è…؛ه¯¼ç®،è…؛癌(PDAC)ن¸€ç؛؟و²»ç–—çڑ„وœ‰و•ˆو€§ه’Œه®‰ه…¨و€§
AACR 2021 posterï¼ڑKN046(PD-L1/CTLA-4هڈŒç‰¹ه¼‚و€§وٹ—ن½“)èپ”هگˆç™½è›‹ç™½ç»“هگˆه‹ç´«و‰é†‡و²»ç–—转移و€§ن¸‰éک´ن¹³è…؛癌و‚£è€…çڑ„هˆو¥ه®‰ه…¨و€§م€پè€گهڈ—و€§ه’Œç–—و•ˆç»“وœ
WCLC 2020 Mini oral reportï¼ڑKN046هœ¨ç½•è§پ胸部è‚؟çک¤و‚£è€…ن¸çڑ„هˆو¥ه®‰ه…¨و€§ه’Œوœ‰و•ˆو€§ç»“وœ
WCLC 2020 posterï¼ڑKN046用ن؛ژو²»ç–—و™ڑوœںéه°ڈ细èƒè‚؛癌(NSCLC)و‚£è€…çڑ„â…،وœںن¸´ه؛ٹç ”ç©¶و•°وچ®
ASCO-GI 2020 posterï¼ڑKN046èپ”هگˆو”¾هŒ–ç–—و²»ç–—ه¤چهڈ‘ه’Œè½¬ç§»و€§é£ںç®،é³ç™Œçڑ„هˆو¥ç–—و•ˆه’Œه®‰ه…¨و€§و•°وچ®
ASCO 2020 posterï¼ڑKN046(PD-L1/CTLA-4هڈŒç‰¹ه¼‚و€§وٹ—ن½“)ه¯¹و—¢ه¾€ه…چç–«و£€وں¥ç‚¹وٹ‘هˆ¶ه‰‚و²»ç–—و— و•ˆçڑ„و‚£è€…çڑ„هˆو¥ç–—و•ˆه’Œه®‰ه…¨و€§و•°وچ®
ASCO 2019 posterï¼ڑKN046(وٹ—PD-L1/CTLA4هڈŒç‰¹ه¼‚و€§وٹ—ن½“)首و¬،ن؛؛ن½“试éھŒï¼Œهœ¨و™ڑوœںه®ن½“çک¤ن¸ه®‰ه…¨و€§م€پç–—و•ˆه’Œèچ¯ن»£هٹ¨هٹ›ه¦çڑ„هˆو¥ç»“وœ
